烟酰胺腺嘌呤二核苷酸(NAD)是一类重要的辅酶,参与许多关键的细胞生理过程。烟酰胺磷酸核糖转移酶(NAMPT)是NAD合成回补途径中的限速酶,在NAD生物合成中发挥重要作用。脊椎动物NAMPT与寿命和癌症密切相关,其催化机理和抑制机理已经研究得较为透彻,但细菌NAMPT的结构和催化机制尚不清楚。
近日,我院明振华团队在Communications Biology(生物学一区,TOP期刊)发表了题为“Structural insights into Xanthomonas campestris pv. campestris NAD+ biosynthesis via the NAM salvage pathway”的研究论文,报道了十字花科黑腐病菌NAMPT蛋白的结构及催化机制。

研究者利用生物信息学方法重构了十字花科黑腐病菌(Xanthomonas campestris pv. Campestris,Xcc)的NAD合成途径,遗传实验发现NAMPT蛋白可以通过回补途径利用烟酰胺NAM合成NAD,并且Xcc NAMPT的酶活远高于人源蛋白(约是人源NAMPT的20倍)。为了阐明Xcc NAMPT的催化机理和活性调节机理,研究人员解析了Xcc NAMPT及其与底物NAM、产物NMN复合物的晶体结构,这也是首个细菌NAMPT的三维结构。研究人员通过凝胶过滤层析、分析超速离心以及突变体酶活恢复实验证明Xcc NAMPT在溶液中以二聚体的形式发挥功能,而底物或产物刚好结合在二聚体的界面上。
研究者发现一个Xcc NAMPT分子可以同时结合两个NAM底物分子,一个结合在活性中心,另一个结合在附近的通道。这个结论得到了ITC实验和酶动力学实验的有力支持:ITC滴定曲线最终拟合的结合位点数为2,且Kd1 < Kd2,说明Xcc NAMPT蛋白确实存在两个NAM结合位点,并且NAM在通道位点的结合与其在催化位点的结合具有正协同效应;酶动力学实验发现Xcc NAMPT对底物NAM的希尔系数约为2,与两个底物结合位点所表现出的正协同性相一致。这些发现强烈地提示通道位点通过结合底物分子,在NAMPT催化过程中发挥重要作用。

图1. Xcc NAMPT与两个NAM分子的复合物晶体结构
为进一步确定通道位点在NAM结合与催化过程中的作用,研究者构建了一个可以堵塞通道的突变体,并通过解析该突变体的晶体结构确认通道已成功堵住。后续实验发现该突变体的正协同效应消失,并且它与NAM的亲和力已经减弱到ITC无法检测的水平。该研究还发现通道突变体对抑制剂FK866的亲和力与抑制敏感性都大大降低,说明该通道对抑制剂的结合并发挥其抑制活性也起到非常重要的作用。
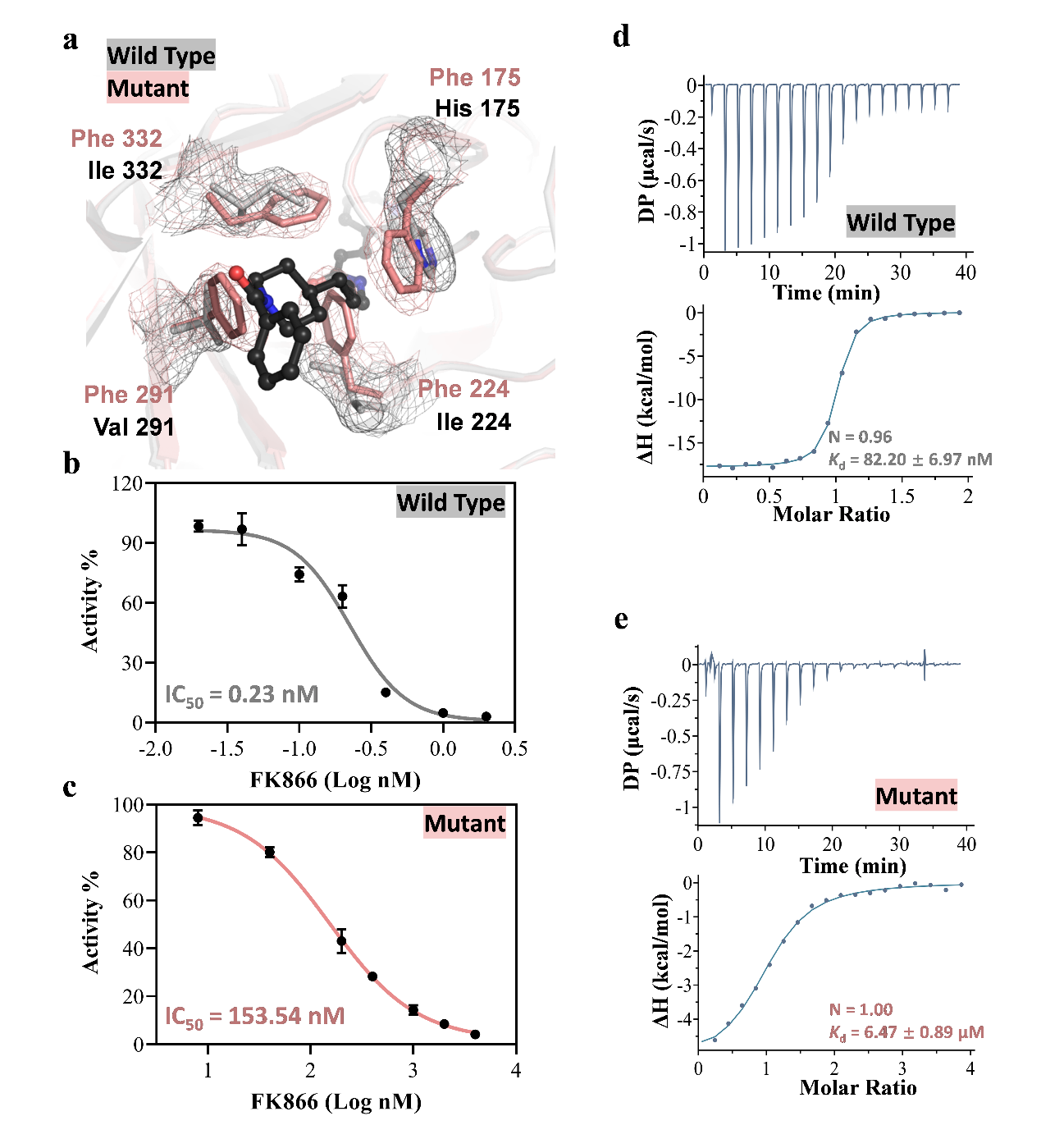
图2. Xcc NAMPT及其通道突变体对抑制剂敏感性的动力学表征
结合序列比对和三维结构分析,该研究指出Xcc NAMPT酶活比人源NAMPT酶活高的原因可能来源于通道入口上方和催化位点上方柔性多肽片段的序列和结构差异。
综上,该研究揭示了十字花科黑腐病菌NAMPT的催化机理和活性调控机理,为NAMPT蛋白抑制剂与激活剂的设计提供了重要线索。Xcc NAMPT高效合成NMN产物的酶学特性,也为抗衰老药物NMN的工业生产提供了重要的酶材料。
广西大学生命科学与技术学院博士毕业生许国绿和博士研究生马劲雪为论文的共同第一作者,明振华教授和唐纪良为共同通讯作者。清华大学医学院闫利明研究员、上海科技大学免疫化学研究所张兵副研究员、清华大学蛋白质研究技术中心常卿博士和褚文丹博士为该研究提供了大力支持与帮助。上海同步辐射光源为衍射数据收集提供了及时有效的支持。该研究得到了国家自然科学基金、广西杰青基金、广西“八桂学者计划”和CSC项目的资助。